活性氧 (ROS)是细胞内进行有氧代谢产生的单电子还原产物,作为胞内重要的信号分子发挥重要功能。癌症中ROS 水平升高被认为是癌症的标志之一,并与癌症的发生发展密切相关。其中,线粒体对细胞 ROS (mROS) 的贡献最大。在线粒体呼吸过程中,由线粒体电子传递链 (ETC) 将电子从三羧酸 (TCA) 循环转移到末端电子受体 O2,从 ETC 泄漏的电子与 O2反应生成 O2−,ETC 失调会导致 mROS 的产生增加。然而,调控 ETC 基因转录以驱动 mROS 产生和癌细胞生长的表观遗传机制仍有待充分表征。

2024年1月3日,刘文教授研究团队与吴振教授研究团队于PNAS在线发表题为“Targeting the PHF8/YY1 Axis Suppresses Cancer Cell Growth Through Modulation of ROS”的研究成果。该研究阐述了PHF8作为转录共抑制因子,通过直接去甲基化非组蛋白底物YY1抑制大量 ETC 基因,从而驱动 ROS 产生和癌细胞生长。基于该分子机制,研究团队进一步筛选获得特异性靶向PHF8酶活性的小分子抑制剂iPHF8。iPHF8能显著地抑制包括结直肠癌和肺癌在内的肿瘤生长。该研究为以PHF8为靶点的抗肿瘤药物开发提供了新思路,为治疗结肠癌、肺癌等癌症提供了一种有前景的策略。这是继刘文教授团队在发现PHF8去甲基化组蛋白H4K20me1激活细胞周期相关基因促进细胞周期进程之后(Nature,2010),在去甲基化酶PHF8的底物鉴定及促癌机制研究的又一个重要的发现。
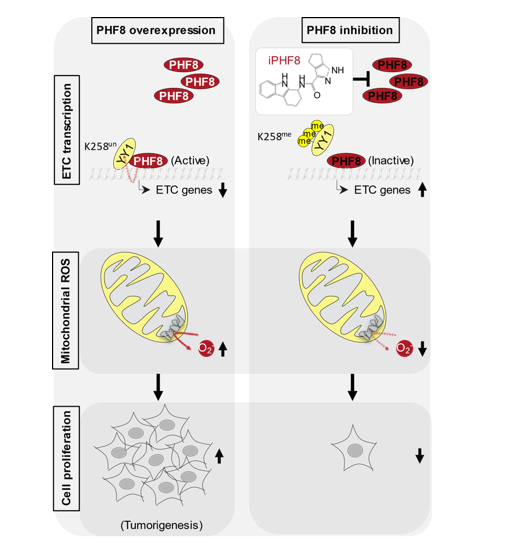
模式图:PHF8介导的YY1 K258去甲基化在ETC基因转录调控、mROS产生和肿瘤细胞生长中的作用机制和靶向干预研究
作者首先通过质谱和ChIP-seq发现PHF8和转录因子YY1相互作用,并在染色质上共定位于基因启动子处(尤其是ETC基因)。进一步研究发现PHF8去甲基化YY1并调控其DNA结合能力以及对PHF8/YY1共结合的ETC基因(PY-ETC)发挥转录抑制作用,促进线粒体ROS产生,从而驱动肿瘤细胞生长。这一调控机制被证实在包括结肠癌和肺癌在内的多种癌症中具有临床意义。此外,作者通过筛选发现了一个选择性高、活性强的PHF8抑制剂iPHF8。iPHF8能有效抑制结肠癌和肺癌中PHF8介导的YY1去甲基化、调控PY-ETC基因转录、抑制线粒体ROS产生和肿瘤生长。
该研究揭示了PHF8介导的YY1去甲基化参与ETC转录调控的关键表观遗传机制,证实PHF8是极具潜力的癌症治疗靶点。所发现的iPHF8小分子为进一步的药物研发提供了方向。
刘文教授和吴振教授为本文的共同通讯作者,该工作主要由吴晓男副教授,博士研究生李佳媛、何琪、李博群共同完成,博士后何耀辉和丁建成等参与了该工作,该工作还得到了高祥副教授的大力支持。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2219352120
(图文:刘文课题组)