脂肪酸吸收是脂肪酸代谢的第一步,也是脂肪酸代谢调控的重要步骤,其代谢紊乱与脂肪肝、心血管疾病和糖尿病等代谢性疾病的发生密切相关[1]。长链脂肪酸的吸收主要有两种方式:透过磷脂双分子层的被动扩散和蛋白辅助的转运[2]。蛋白辅助的脂肪酸转运则是代谢组织器官吸收脂肪酸的主要模式。目前已经有一些参与长链脂肪酸转运的蛋白被陆续鉴定出来,包括清道夫受体CD36(也被称为Fatty acid translocase,FAT)、脂肪酸转运蛋白家族(FATPs)和存在于膜上的脂肪酸结合蛋白(FABPm)等[1, 3],这些蛋白协同作用,促进脂肪酸穿过细胞质膜被吸收和利用。
蛋白质的S-棕榈酰化(protein S-palmitoylation)是一种可逆的蛋白质翻译后修饰,是将棕榈酰基团通过硫酯键的形式共价连接到蛋白质侧链的Cys残基上[4]。蛋白质的动态棕榈酰化修饰是蛋白质定位、细胞内转运和稳定性的一种非常重要的调控方式[5-7]。棕榈酰化由一类活性中心含有Asp-His-His-Cys(DHHC)的棕榈酰转移酶(Palmitoyl Acyltransferase)催化,因此也被成为DHHC家族。DHHCs是一个很大的酶家族,在酵母中有7个成员,而哺乳动物中有20多个成员[6]。人类遗传学的证据表明,DHHC基因的突变与很多疾病的发生密切相关,如肿瘤、智障和亨廷顿氏病等[5]。目前有关DHHC家族生理功能的研究主要集中于其在神经生物学方面的作用,在代谢生物学方面的作用还未见报道。
1月2日,我室赵同金教授课题组在Cell reports上发表了题为DHHC4 and DHHC5 Facilitate Fatty Acid Uptake by Palmitoylating and Targeting CD36 to the Plasma Membrane的研究论文,揭示了两个蛋白质棕榈酰化转移酶DHHC4和DHHC5通过对CD36的棕榈酰化修饰调控细胞的脂肪酸吸收过程。

该研究发现了包括Dhhc4和Dhhc5在内的几个基因在脂肪组织中表达丰度较高,并且发现在脂肪酸吸收过程中发挥重要作用的CD36是DHHC4和DHHC5的底物。定位于高尔基体的DHHC4能够棕榈酰化修饰新生的CD36,并将其分选到细胞质膜上;而位于细胞质膜上的DHHC5则能阻止CD36的去棕榈酰化,从而维持其在细胞质膜的定位(下图)。无论是缺少DHHC4还是DHHC5,CD36都不能定位在细胞表面,从而丧失脂肪酸吸收的活性。
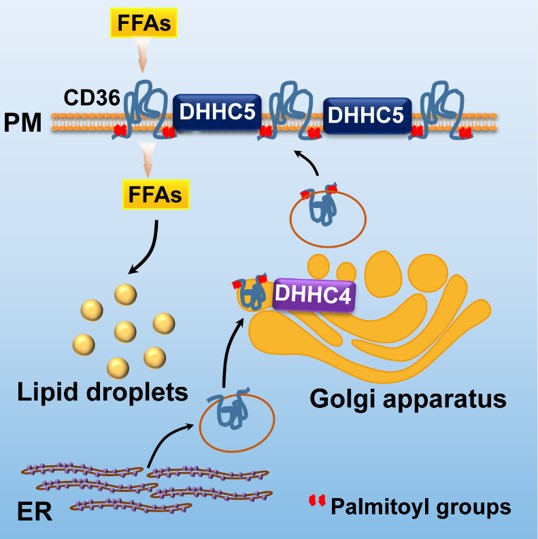
进一步的研究发现,在Dhhc4全身敲除和脂肪组织特异性敲除的小鼠中,脂肪组织吸收脂肪酸的能力显著下降。并且由于棕色脂肪组织脂肪酸吸收能力的下降,这两种小鼠对急性冷刺激都非常敏感,与对照小鼠相比体温下降明显加快。这些表型与CD36基因敲除的表型非常类似[8, 9]。这些研究表明,在生理水平上DHHC4和DHHC5能够通过CD36调控脂肪酸吸收的过程。
总的来说,该研究成果发现了棕榈酰化修饰对CD36脂肪酸吸收活性的调控作用,并且将蛋白质棕榈酰化的研究拓展到代谢生物学领域。
博士生王娟、郝建伟和王旭以及助理教授郭慧玲为该论文的共同第一作者,赵同金教授为该论文的通讯作者。同时,该课题获得了包括我室莫玮和王洪睿教授课题组、清华大学长三角研究院的周海梦教授课题组、南京大学模式生物研究所的陈帅课题组以及美国西南医学中心梁国生课题组的大力支持。
论文链接:https://www.sciencedirect.com/science/article/pii/S2211124718319338
参考文献:
1. Su, X., and Abumrad, N.A. (2009). Cellular fatty acid uptake: a pathway under construction. Trends Endocrinol. Metab. 20, 72-77.
2. Hajri, T., and Abumrad, N.A. (2002). Fatty acid transport across membranes: relevance to nutrition and metabolic pathology. Annu. Rev. Nutr. 22, 383-415.
3. Pepino, M.Y., Kuda, O., Samovski, D., and Abumrad, N.A. (2014). Structure-function of CD36 and importance of fatty acid signal transduction in fat metabolism. Annu. Rev. Nutr. 34, 281-303.
4. Resh, M.D. (2006). Trafficking and signaling by fatty-acylated and prenylated proteins. Nat. Chem. Biol. 2, 584-590.
5. Fukata, Y., Murakami, T., Yokoi, N., and Fukata, M. (2016). Local Palmitoylation Cycles and Specialized Membrane Domain Organization. Curr Top Membr 77, 97-141.
6. Greaves, J., and Chamberlain, L.H. (2011). DHHC palmitoyl transferases: substrate interactions and (patho)physiology. Trends Biochem. Sci. 36, 245-253.
7. Linder, M.E., and Deschenes, R.J. (2007). Palmitoylation: policing protein stability and traffic. Nat. Rev. Mol. Cell Biol. 8, 74-84.
8. Coburn, C.T., Knapp, F.F., Jr., Febbraio, M., Beets, A.L., Silverstein, R.L., and Abumrad, N.A. (2000). Defective uptake and utilization of long chain fatty acids in muscle and adipose tissues of CD36 knockout mice. J. Biol. Chem. 275, 32523-32529.
9. Putri, M., Syamsunarno, M.R., Iso, T., Yamaguchi, A., Hanaoka, H., Sunaga, H., Koitabashi, N., Matsui, H., Yamazaki, C., Kameo, S., et al. (2015). CD36 is indispensable for thermogenesis under conditions of fasting and cold stress. Biochem. Biophys. Res. Commun. 457, 520-525.