近日,我室林圣彩教授和林舒勇教授研究团队在《Nature Cell Biology》杂志上发表了题为“AIDA directly connects sympathetic innervation to adaptive thermogenesis by UCP1”的研究论文。该工作阐述了一种未曾发现的在急性寒冷刺激下的体温调节机制。
AIDA最早是由林圣彩教授团队首先鉴定和命名的。2007年林圣彩教授团队与孟安明院士团队合作发现AIDA在斑马鱼体轴发育中的功能(Rui, 2007)。2018年,林圣彩教授团队首次发现了AIDA在哺乳动物中的功能,即AIDA介导的内质网降解途径通过降解脂肪合成途径中的关键酶,而限制膳食脂肪在肠道的吸收这一内在抵御肥胖(Luo, 2018)。而本次成果揭示了AIDA在棕色脂肪组织中特定的功能。这些工作将AIDA引入了脂质应激代谢的重要环节,包括脂质吸收和依赖于脂质的产热过程。
棕色脂肪组织是哺乳动物体温调节的重要效应组织,在寒冷刺激下,会接收交感神经系统的指令而消耗能源物质以产生热量,以维持体温。而在棕色脂肪中特异性且高度表达的、定位于线粒体内膜的跨膜通道蛋白质UCP1是这个过程的最终的效应分子。UCP1活化的时候,原本用于产生ATP的质子梯度由于UCP1解偶联的作用而“泄露”,即从线粒体膜间隙进入线粒体基质,“顺便”产生了大量的热。近年来大量的研究探讨了UCP1的转录调节机制,发现了众多以UCP1的mRNA和蛋白质丰度为最终作用目标的寒冷感应机制。值得注意的是,在室温下棕色脂肪中的UCP1蛋白即已达到极高水平,而在急性寒冷刺激下棕色脂肪组织的UCP1蛋白水平并不会大幅提高。鉴于UCP1对急性寒冷刺激下的体温维持非常重要,某些独立于UCP1蛋白质丰度调控的其他机制很可能是急性冷刺激下棕色脂肪组织中UCP1活化的关键。然而此前尚无报道是否存在一种直接的效应分子能够将交感神经信号与急性寒冷应激反应中UCP1的激活联系起来。
该研究团队发现由其首先鉴定并命名的含有C2结构域的蛋白质AIDA,在急性寒冷刺激下的体温维持中发挥着重要作用。急性寒冷刺激时,AIDA全身敲除、脂肪特异性敲除或棕色脂肪特异性敲除小鼠都呈现体温下降速率加快、产热能力下降的现象。通过大量机制性研究,该团队发现,寒冷刺激通过交感神经系统激活棕色脂肪的肾上腺能信号通路,其下游的核心蛋白激酶A(PKA)将AIDA的第161位丝氨酸基团磷酸化修饰,磷酸化的AIDA转移到线粒体内外膜间隙,与定位于线粒体内膜的跨膜解偶联蛋白UCP1相结合,促进UCP1半胱氨酸基团的氧化修饰,并激活UCP1的解偶联活性,从而促进棕色脂肪组织的产热作用。如果在AIDA缺失小鼠的棕色脂肪细胞中回补无法被磷酸化修饰的AIDA,并不能像回补野生型AIDA那样使小鼠恢复急性寒冷刺激下的产热能力。此前有研究发现,逐步降温适应后的寒冷环境中小鼠中,UCP1的活性并非必不可少。与此呼应的是,该团队也发现,AIDA敲除小鼠的各项指标在逐步降温适应后的寒冷环境中并未出现明显异常。这进一步表明,急性寒冷刺激和逐步适应性寒冷环境对机体的体温调节系统的重塑是经由不同的机制。
此外,由于研究中发现AIDA的161位丝氨酸及其附近区域在哺乳动物中高度保守,而棕色脂肪的适应性产热对冬眠动物极为重要,该研究团队还初步探究了PKA-AIDA-UCP1这一信号通路在多种冬眠物种中的保守性。同时,该团队发现在现存的在进化上最接近脊椎动物的物种——文昌鱼中,AIDA的161位丝氨酸对应基团被脯氨酸代替,也失去了被PKA磷酸化的能力,但只要将文昌鱼AIDA中对应的脯氨酸更替为丝氨酸,就能接通文昌鱼中的PKA-AIDA间的通信。这在文昌鱼的生理功能乃至进化生物学上有何意义值得进一步探索。
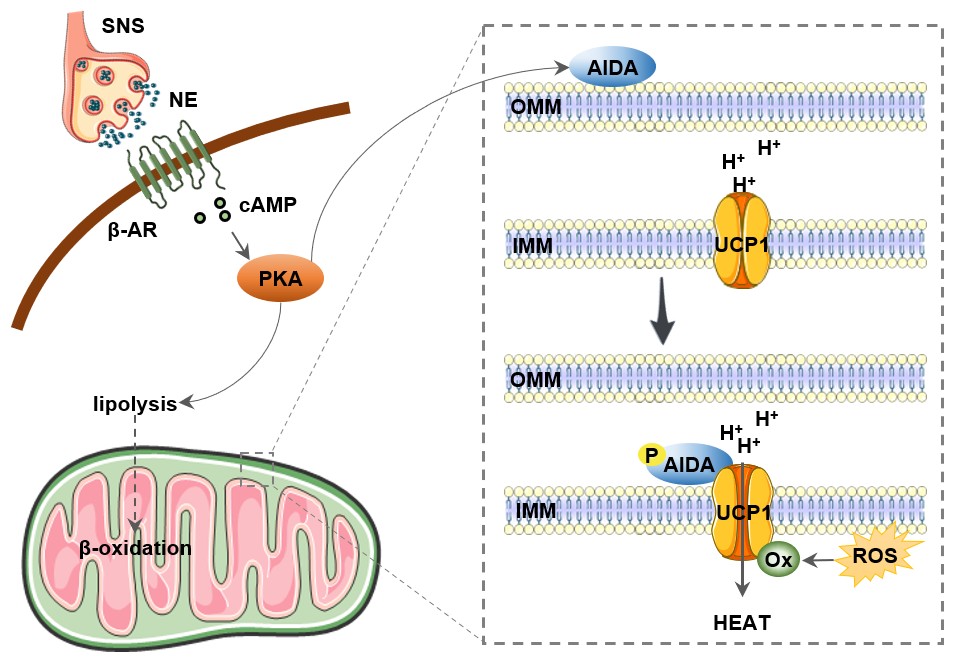
图:AIDA通过UCP1直接将交感神经系统与适应性产热串联起来的模式图
该论文的共同第一作者为我院博士生史猛和硕士生黄晓羽,林圣彩教授和林舒勇教授则为共同通讯作者。该工作得到了厦门大学实验动物中心和生物医学学部仪器平台的重要协助和国家重点研究和发展项目,国家自然科学基金,厦门大学校长基金等的支持。
论文连接:https://dx.doi.org/10.1038/s41556-021-00642-9