细胞无时无刻不在对营养物质的可获得性作出反应并维持物质和能量的平衡,这是生物学的基本问题之一。AMPK和mTORC1是感知细胞内营养物质水平、调节代谢平衡,以及调控细胞生长的两大中枢激酶复合体。(注:mTOR有两种复合体,即mTORC1和mTORC2,本文着重讨论在营养感知中起重要作用的mTORC1)。他们分别通过调节一系列下游途径发挥其功能:AMPK感知营养和能量水平较低的状态,并在此条件下被激活,抑制合成代谢途径以减少ATP的消耗,促进分解代谢途径以增加ATP的产出,并抑制细胞的生长以最终保证能量稳态——可视为“阴”的一面;mTORC1则在营养物质丰裕的情况下被激活,通过促进合成代谢的方式加快细胞的生长,被视为“阳”(图1)。正如道学之所言,阴阳之间相济相克,AMPK和mTORC1之间也有着复杂而精细的相互制约的调控机制。今年3月4日,Cell Metabolism杂志在线发表了由AMPK领域的权威Grahame Hardie教授和TOR的领域权威Michael Hall教授,以及林圣彩教授等人撰写的长文综述:AMPK and TOR: the Yin and Yang of Cellular Nutrient Sensing and Growth Control[1],对上述几个方面,特别是经典的和近年来新发现的对这两大分子如何感知物质、能量水平,以及如何相互调节的成果进行了详尽的介绍,从而为我们全景式地展现了两大分子“阴阳相济”地调节细胞生长的分子机制。

图1 AMPK和mTOR分别代表了调节代谢稳态的“阴”和“阳”两面
作者们首先从AMPK的调控入手,系统介绍了AMPK在不同物种中的保守性,并结合结构生物学的证据,详细阐述了其激活的分子机制。AMPK的α亚基含有激酶活力,其第172位苏氨酸(T172)的磷酸化修饰是激活的关键。这一磷酸化是由上游激酶LKB1所介导的。除了上游激酶,AMPK的另一个重要的调节分子是代表低能量的5’-AMP——这也是AMPK得名的缘由,AMP是两分子ADP在腺苷酸激酶作用下形成的产物,该反应还产生一分子ATP,因此在能量水平即ATP水平下降时,AMP水平上升。AMP能够结合AMPK的γ亚基,引起AMPK全酶,特别是α亚基上变构,从而促进T172位点的暴露使之更容易被LKB1所磷酸化。同时,AMP还能够保护T172磷酸化不被磷酸酶所去除,以及直接通过别构激活的方式数倍地提高AMPK的活力。上述的由LKB1和AMP所代表的“低能量”状态所介导的AMPK的激活过程被称为“经典(canonical)途径”。除外,AMPK还能被一系列非经典(non-canonical)途径所激活。例如,另一个上游激酶CaMKK2可以在钙离子浓度升高时直接磷酸化T172;β亚基可以结合如水杨酸这样的天然产物或者人工合成的激动剂引起AMPK的别构激活。
近年来发现的和葡萄糖感知有关的AMPK激活的分子机制则大大拓展了长期被认为是能量感知器的AMPK的“非经典的”生理意义,甚至这一葡萄糖感知被誉为AMPK的始祖功能(ancestral role)。为此作者们进行了重点介绍。葡萄糖是机体内最为“平常的”营养物,作为细胞最基本的物质和能量来源,其重要性不言而喻。然而,葡萄糖水平的下降也是十分常见,例如餐前、激烈运动、正在辟谷的人群中血液中葡萄糖的水平是降低的。因此,感应葡萄糖水平的下降并对机体的代谢加以调节就成为了AMPK功能的重点所在。研究表明,葡萄糖饥饿可以直接被感知并引起AMPK的激活,这一过程不仅需要LKB1,还需要构架蛋白AXIN的参与,且该过程发生在溶酶体表面:葡萄糖饥饿能够通过其代谢产物果糖1,6-二磷酸水平的下降,被结合在溶酶体上的v-ATPase上的醛缩酶所感应;一旦该醛缩酶没有FBP可结合时,醛缩酶便能抑制内质网上TRPV钙通道,使得低糖信号转化成低钙信号,此时TRPV又能同时与邻近的溶酶体上的V-ATPase结合,使之产生构象变化,并导致了同样定位在溶酶体上的Ragulator复合体之间发生变构。此时,架构蛋白AXIN和与之结合的AMPK上游激酶LKB1一同迁移到溶酶体表面并和v-ATPase-Ragulator复合体相互作用并激活溶酶体膜上的AMPK,这一过程被称为“AMPK激活的溶酶体途径”(图2——关于经典途径和非经典途径的详细描述可参考引文[2])。有意思的是,溶酶体途径和经典途径相互独立,却又相互补充:葡萄糖水平下降在引起AMP水平升高之前就能激活AMPK,即可提前被它的感受器感知从而关闭合成代谢,启动分解代谢,保证生命活动的有序进行;而更加严重的营养物质缺乏引起了AMP水平升高时,后者进一步结合AMPK并进一步提高AMPK的活力,引起更广泛的底物的调控,使机体能够更充分地应对此时的应激压力[3]。同时必须指出的是,尽管葡萄糖饥饿引发AMPK激活的过程不依赖AMP水平的升高,但γ亚基上的第四个AMP结合位点对细胞内本底水平的AMP的结合仍然该过程所需要的,故而AMP在这个意义上可被理解为一种“辅因子(co-factor)”[3]。
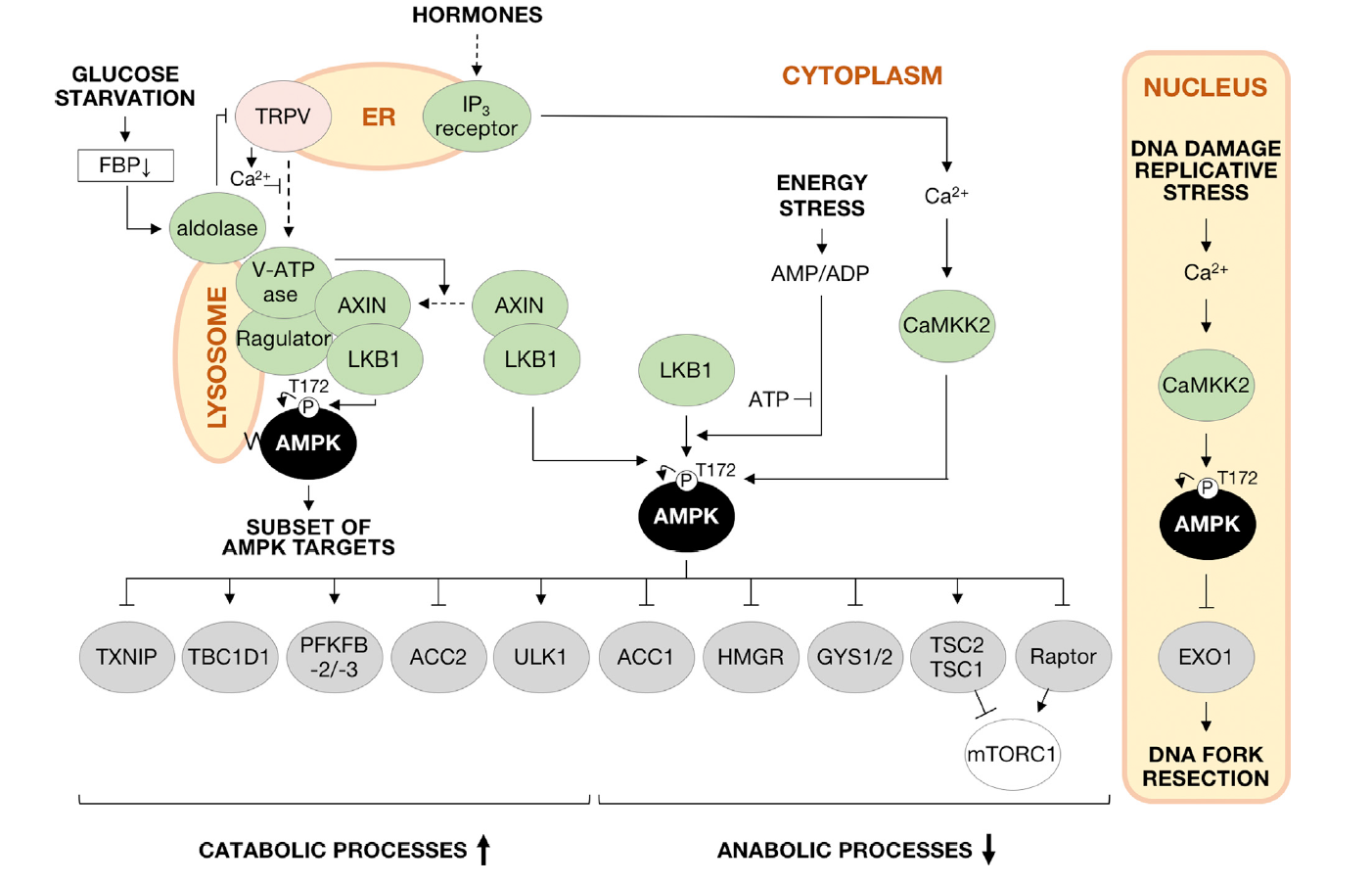
图2经典的和非经典的AMPK激活的途径[1]
限于篇幅,作者们简要地阐述了AMPK如何通过磷酸化各式底物促进葡萄糖转运和分解代谢、促进脂肪酸氧化、抑制蛋白质合成、抑制脂肪酸合成、促进线粒体氧化磷酸化作用和促进自噬作用等方式,维持细胞的物质和能量平衡(关于AMPK的底物和功能的详细介绍,可参考文献[4])。而这其中,mTORC1是一个重要的AMPK底物和调控节点。
和AMPK类似,mTORC1也是一个从酵母到哺乳动物都保守存在的复合体,它的功能是通过促进蛋白质的翻译以及合成、抑制自噬作用、促进脂肪酸和核酸的合成等方式,促进细胞的生长和增殖。因此,mTORC1激活需要在细胞同时满足生长因子、葡萄糖、氨基酸、氧气充足和能量水平高的情况下才能被激活,任意一个条件不满足,mTORC1就会被抑制。并且,mTORC1是一个在溶酶体膜表面被激活的蛋白质激酶复合体,溶酶体膜表面锚定有mTORC1激活所需要的几个重要分子,包括可被TSC2抑制的RHEB和前述的v-ATPase、Ragulator等。关于mTORC1调控的详细介绍,可参考文献[5]。从mTORC1的调控模式上看,分解代谢调控者AMPK一旦被激活,必然就会抑制mTORC1的活性。研究表明,AMPK至少可以通过两条相互平行的途径来抑制mTORC1:其一是通过磷酸化TSC2以直接抑制RHEB和mTORC1的活力;其二是通过直接磷酸化mTORC1复合体上的RAPTOR,造成复合体结构上的变化从而抑制该复合体的活力。这种进化上的“双保险”很可能确保了mTORC1可以在营养物质或者能量水平下降之时被有效地抑制(图3)。

图3mTOR的活力受到严格的调控[1]
尽管它们是激活的条件恰好是相反的,AMPK和mTORC1这两种激酶复合体却能使用相同的分子v-ATPase和Ragulator,在溶酶体表面被激活,这种机制进一步地提供了对两种处在“对立面”上的感知器的精确调控。的确,正如林圣彩和张宸崧教授在今年二月在Cell Metabolism发表的Preview中列举的[6],葡萄糖饥饿本身可以在激活AMPK的同时通过另一些平行的途径抑制mTORC1的活力,从而通过多重的机制加以保证mTORC1被精确的调节:AXIN迁移到溶酶体膜上时,在激活AMPK的同时也能够改变Ragulator-RAG复合体,加速mTORC1从溶酶体上的解离以抑制其活力。新近还发现,AMPK能够通过激活下游的ULK1分子,再进一步磷酸化LARS1这一亮氨酰-tRNA合成酶,再通过调节RAG而促进mTORC1的解离(图4)。
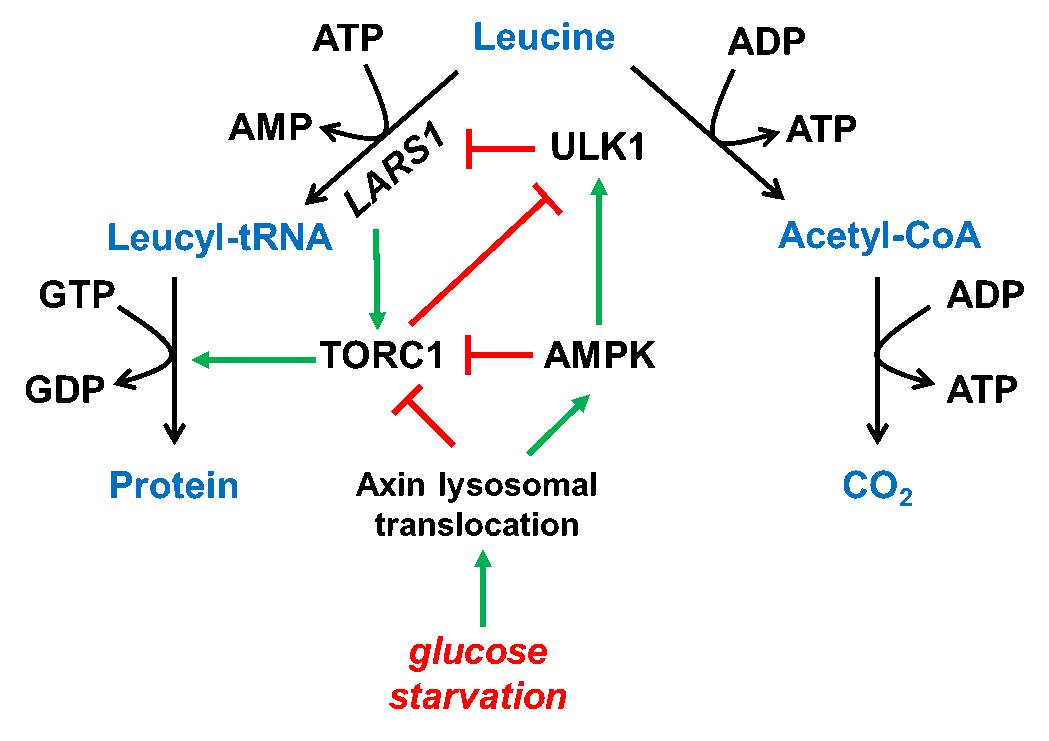
图4葡萄糖饥饿对mTORC1以及翻译过程的多重调控节点[6]
除此之外,新近的研究还发现,mTORC1也能够在激活的状态下抑制AMPK的活力,亦即“阳”对“阴”的调节[7]。不过需要指出的是,这种调节mTORC1是对在营养充足条件下本底活力已经很低的AMPK的进一步抑制,可视为是一种精细的调节。
总之,AMPK和mTORC1分别感应不同的营养物质状态,调节相反的代谢过程,行使相对应的生物学功能,分别代表了“阴”和“阳”的两面,而他们之间又存在着千丝万缕的联系。正所谓“致广大而尽精微,极高明而道中庸”,他们阴阳相济,交合通达,精密而准确地保证细胞内的代谢稳态,共同维持了细胞乃至机体的健康。更有趣的是,从促进长寿意义上说,AMPK则是“阳”,也应验了老祖宗的阴中有阳,阳中有阴了吧?
论文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(20)30058-9