2019年6月20日,我室林树海教授课题组在《Nature Communications》上合作发表题为“Identification of metabolic vulnerabilities of receptor tyrosine kinases-driven cancer”的研究论文,报道了受体酪氨酸激酶驱动下的代谢偏向性和代谢抑制剂的个体化治疗效果。

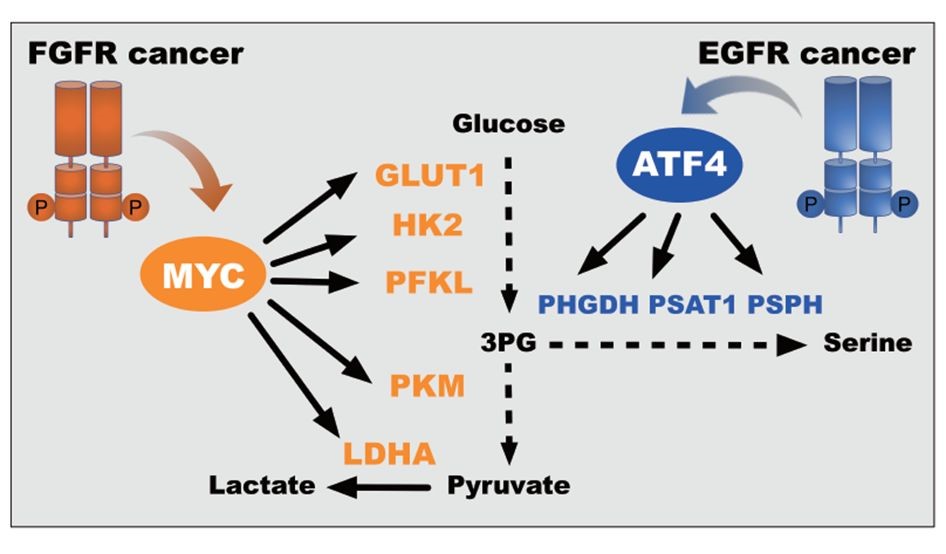
肿瘤的代谢异质性(Metabolic heterogeneity)是指不同肿瘤或同一肿瘤组织内部的代谢特征因遗传因素、饮食或微环境等的不同而显著差异。这种异质性是导致当前针对代谢抗肿瘤效果欠佳的重要原因之一。为此,我们需要鉴定不同肿瘤群体对代谢通路的依赖性差异,寻找其代谢弱点(Metabolic vulnerability),进而遴选不同的肿瘤患者群体,选择合适的代谢抑制剂进行个体化治疗。
本研究以受体酪氨酸激酶为切入点,建立肿瘤代谢依赖性与临床现有的癌基因分子分型的关系,为代谢抑制剂敏感人群的遴选提供指导。重点以非小细胞肺癌重要的分子分型EGFR突变和FGFR扩增为例,发现了EGFR突变肿瘤高度依赖丝氨酸合成通路,而FGFR扩增指征肿瘤对乳酸合成的依赖,为丝氨酸合成和乳酸合成抑制剂的敏感群体选择指明了方向。
为了鉴定代谢弱点,中国科学院上海药物研究所黄敏和耿美玉研究员和我室林树海教授密切合作,利用受体酪氨酸激酶驱动的BAF3细胞体系,以及相应基因型的细胞株和人源肿瘤组织来源移植瘤PDX模型,使用多种代谢抑制剂,整合非靶向代谢组学和多种稳定同位素标记的代谢流分析,以及转录组学进行系统分析,证实了EGFR突变和FGFR扩增作为丝氨酸代谢和乳酸合成抑制剂敏感标志物的可行性,为同类代谢抑制剂的个性化治疗提供了重要信息,为代谢抑制剂敏感群体研究提供了新的思路。
另外,林树海教授近日还与上海交通大学医学院童雪梅研究员合作在《Cancer Research》上合作发表题为“Transketolase deficiency protects the liver from DNA damage by increasing levels of ribose 5-phosphate and nucleotides”,均结合代谢组学和体内外代谢流分析方法,鉴定肿瘤发生发展过程中的代谢特征与调控机制。目前,课题组已初步形成了分析化学、生物化学、分子生物学和生物信息学的跨学科研究团队,聚焦在代谢组学新技术新方法的开发,代谢网络和代谢通路流量的数学建模,以及肿瘤特别是肿瘤微环境的代谢调控机制研究,期待不同学科背景的青年才俊加盟!