线粒体是细胞的能量工厂,其结构完整性和功能稳定性对于维持细胞的能量与物质代谢至关重要——特别是当细胞遇到代谢压力的时候。细胞内有一系列机制来维持线粒体的结构和功能,其中之一就是线粒体形态的动态调控:线粒体通过融合或分裂,应对细胞所处的代谢压力。尽管其机制还有待于进一步阐明,但人们已经发现,当有些线粒体结构遭到损坏,有氧呼吸能力下降,细胞可以通过促进这部分线粒体和正常的线粒体融合实现“收购与重组”,藉此维持线粒体功能的完整以抵御代谢压力,维持代谢稳态。细胞或将损坏严重线粒体予以消化,即线粒体自噬(mitophagy)。细胞还经常遇到营养物质缺乏的情形,如氨基酸的匮乏,然而细胞如何感受这些压力并调节线粒体的形态以维持代谢稳态还知之甚少。
在氨基酸中,谷氨酰胺是一类含量丰富,功能重要的非必需氨基酸,其功能可以概括为两个主要方面。其一是通过谷氨酰胺酵解途径生成α-酮戊二酸直接进入线粒体的柠檬酸循环参与有氧呼吸和合成代谢。通过柠檬酸循环,谷氨酰胺还可进一步转化为乙酰辅酶A等前体参与如脂质合成等合成代谢反应。二是维持细胞的氧化还原平衡,清除活性氧自由基(ROS - reactive oxygen species):谷氨酰胺的代谢产物谷氨酸直接参与了谷胱甘肽的合成,或者被氧化促进NADPH的合成。总效果是为细胞提供了还原力以及合成代谢所需要的物质和能量。
正是因为谷氨酰胺如此重要的功能,在某些条件下,特别是在肿瘤组织中,谷氨酰胺被大量消耗而处于很低的水平,乃至被称为“条件性必需氨基酸”,用以维持肿瘤细胞快速的生长和增殖(这一点与肿瘤细胞对葡萄糖的大量消耗有些相似)。人们发现,在缺乏谷氨酰胺的情况下,线粒体融合被显著地增强了,细胞通过这种方式增强呼吸链的运行效率,提高线粒体产能的能力以度过危机,这一功能被认为在肿瘤发展过程中具有重要的作用。然而,这一过程中的谷氨酰胺感受器尚不明了。尽管大量研究已经表明mTORC1是细胞内的多种氨基酸的感受器,但并未发现mTORC1有调节线粒体形态的功能。
日前,我院林圣彩教授课题组在《Cell Research》杂志上在线发表了题为“Glutaminase GLS1 senses glutamine availability in a non-enzymatic manner triggering mitochondrial fusion”的研究论文,发现了细胞感应谷氨酰胺并调节线粒体形态的感受器,更新了人们对于线粒体形态的动态调节和代谢稳态调节方式的认识。
在这项研究中,研究人员首先证实了是谷氨酰胺本身而不是其上下游的某个代谢产物的缺失引起了线粒体的融合。为了证明这一点,他们通过应用一系列改变细胞内谷氨酰胺代谢途径中间产物水平的方法。他们进一步发现谷氨酰胺酶(glutaminase 1 - GLS1, 即将谷氨酰胺这一底物转化成α-酮戊二酸的酶)是细胞的谷氨酰胺感应器,在缺失了GLS1的细胞中,谷氨酰胺的缺乏无法引起线粒体的融合(图)。
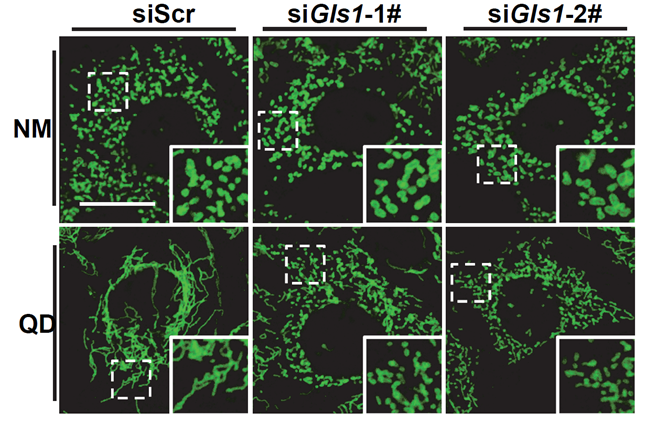
图:GLS1缺失的细胞无法响应谷氨酰胺缺失并引起线粒体融合。敲低GLS1(siGLS1-1#和siGLS1-2# - 两种独立的siRNA)或者野生型(siScr - 对照siRNA)的MEF细胞培养在完全培养基(NM)或者谷氨酰胺缺失的培养基(QD)中,其线粒体形态由TOM20的抗体(绿色)表示。
有意思的是,谷氨酰胺感受器GLS1在此过程中发挥了其非酶功能:导入谷氨酰胺酶活力缺失的GLS1仍可以引起正常的线粒体融合。相反地,导入GLS1的四聚化——被认为是该酶结合谷氨酰胺所必需——的突变体就无法补救GLS1的缺失,细胞中的线粒体就不能进行融合,表明是GLS1的底物结合的结构域本身介导了感知谷氨酰胺的水平。
林圣彩教授课题组还在新发现的GLS1作为谷氨酰胺感受器这一分子模型下观察了谷氨酰胺缺乏的情况下线粒体融合消除ROS的现象,证明了敲低GLS1,或者导入不能引起线粒体融合的GLS1突变体,谷氨酰胺缺乏能引起严重的细胞内ROS水平升高。
该研究不但阐述了谷氨酰胺酶GLS1作为谷氨酰胺感受器的分子机制,还揭示了谷氨酰GLS1作为代谢酶之外的又一重要生物学功能,即非酶功能,与他们实验室之前发现葡萄糖酵解通路中的醛缩酶(aldolase)是感知葡萄糖水平的感受器分子,如出一辙。需要指出的是,尽管该研究也揭示了线粒体融合因子MFN2是谷氨酰胺缺乏情况下参与GLS1介导的线粒体融合的重要因子,但是GLS1如何调节MFN2并调节线粒体融合的最终机制还有待进一步阐明。
总的来说,林圣彩组的该项发现为日后连接GLS1到MFN2的相关信号传递分子机制有着重大的意义,届时人们对于线粒体形态的动态调节和代谢稳态调节的方式方法将会有更新更全面的认识。
该论文的第一作者为博士生蔡炜锋,通讯作者为林圣彩教授及其课题组的博士后张宸崧博士。
论文链接:https://www.nature.com/articles/s41422-018-0057-z