外周神经病变影响大量人群,并构成了巨大的经济和社会负担,然而现有的针对外周神经病变的治疗方法疗效不佳1。施旺细胞是外周神经系统中主要的胶质细胞,可通过形成绝缘的髓鞘来支持大直径轴突,或将小直径轴突包裹成束,对神经发育和结构维持至关重要;髓鞘化施旺细胞病变会导致神经元电信号传导受损,导致脱髓鞘疾病的发生;非髓鞘化施旺细胞病变会导致小直径感觉纤维受损,造成神经病理性疼痛2,3。另一方面,细胞内部稳态的维持对施旺细胞十分重要,但其调控机制尚不清楚。因此,了解施旺细胞的稳态维持机制及其功能在外周神经病变中的作用对基础研究和临床具有重大意义。
2023年7月14日,细胞应激生物学国家重点实验室、厦门大学生命科学学院、厦门大学附属妇女儿童医院的张亮教授课题组在Cell Reports上发表了题为Nucleoporin Seh1 maintains Schwann cell homeostasis by regulating genome stability and necroptosis的论文,揭示核孔蛋白Seh1在施旺细胞基因组完整性维持和外周神经系统中的功能和作用机制。

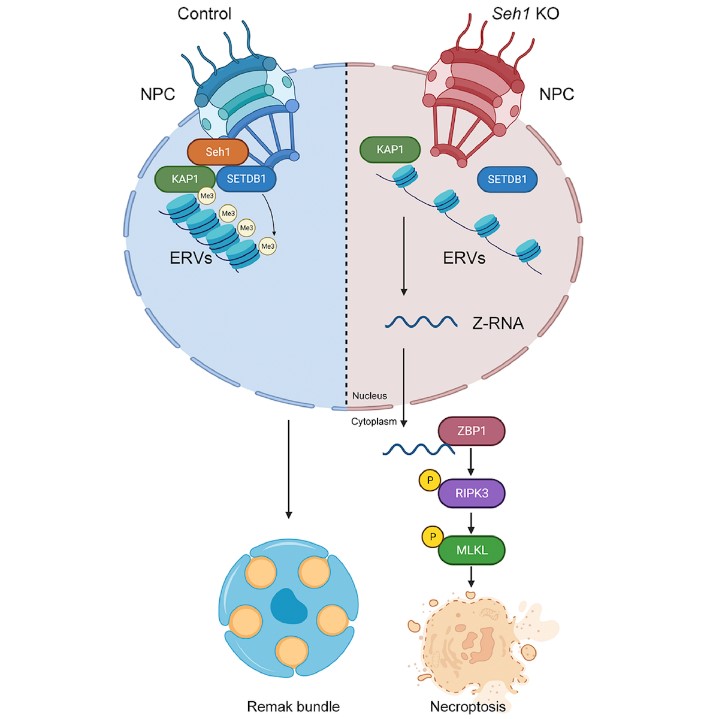
该团队于2019年发表在Neuron杂志上的工作证明了作为核孔复合体组分的核孔蛋白参与中枢神经系统的髓鞘形成4。基于此,他们对核孔蛋白在外周神经系统中扮演何种角色展开一系列研究。首先发现随着小鼠年龄的增长,许多核孔蛋白的表达量显著减少。考虑到施旺细胞在外周神经和髓鞘生成中的作用,研究人员进一步构建了核孔蛋白Seh1施旺细胞谱系特异性敲除的小鼠,发现该基因缺失并未引起髓鞘生成的明显异常,但会造成小鼠坐骨神经中非髓鞘化施旺细胞的逐渐减少,并伴随小直径神经纤维的变性以及感觉系统功能障碍。进一步的研究发现Seh1基因缺失的坐骨神经中有坏死的发生和免疫反应的激活。机制研究发现,Seh1通过介导组蛋白甲基转移酶SETDB1和其支架蛋白KAP1之间的相互作用来实现对染色质的甲基化抑制,以维持基因组的稳定性。Seh1缺失后,SETDB1-KAP1相互作用的破坏使内源性逆转录病毒(Endogenous retroviruses,ERVs)失去抑制,从而触发非髓鞘化施旺细胞中非经典通路的程序性坏死。此外,该研究发现使用抑制ERVs产生的药物TDF(tenofovir disoproxil fumarate)处理Seh1基因敲除小鼠,能够在一定程度上缓解其神经异常,为以抑制内源性逆转录病毒的产生治疗外周神经病变提供了新思路。
综上,该研究阐明了核孔蛋白Seh1在外周神经系统中的生理功能和作用机制,并揭示了核孔蛋白通过调节基因组稳定性和坏死维持外周神经系统胶质细胞稳态的分子机制,为外周神经病变的诊疗提供了新的思路。
硕士生武媚、博士生李满、刘伟为共同第一作者,通讯作者为张亮教授。本研究得到了莫玮教授以及厦门大学附属成功医院张玲教授和厦门大学附属妇女儿童医院张雪芹教授等的大力支持与帮助。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00813-6